間欠的腎代替療法【IRRT】
IRRT:intermittent renal replacement therapyについての解説
この記事はで読むことができます。
- 間欠的腎代替療法(IRRT)について
- 血液透析(HD)、血液濾過(HF)、血液濾過透析(HDF)の回路構成と特徴
- 血液透析(HD)、血液濾過(HF)、血液濾過透析(HDF)の特徴
- 血液透析(HD)、血液濾過(HF)、血液濾過透析(HDF)の臨床適応
Table of Contents 表示
血液透析(HD:hemodialysis)

血液透析の特徴
HDは、血液側と透析液側の濃度差を推進力としる拡散によって、膜を介して物質の除去を行っている。
除去の対象(BUN、Cre、K、Pなど)となる物質は血液側の濃度が高いため、血液側から透析液側へ移動する。
逆に血液側に不足している物質(HCO3–など)は透析液側から血液側へ移動し補充される。
拡散効率を高めるために、血液と透析液を反対方向に流している。(向流)
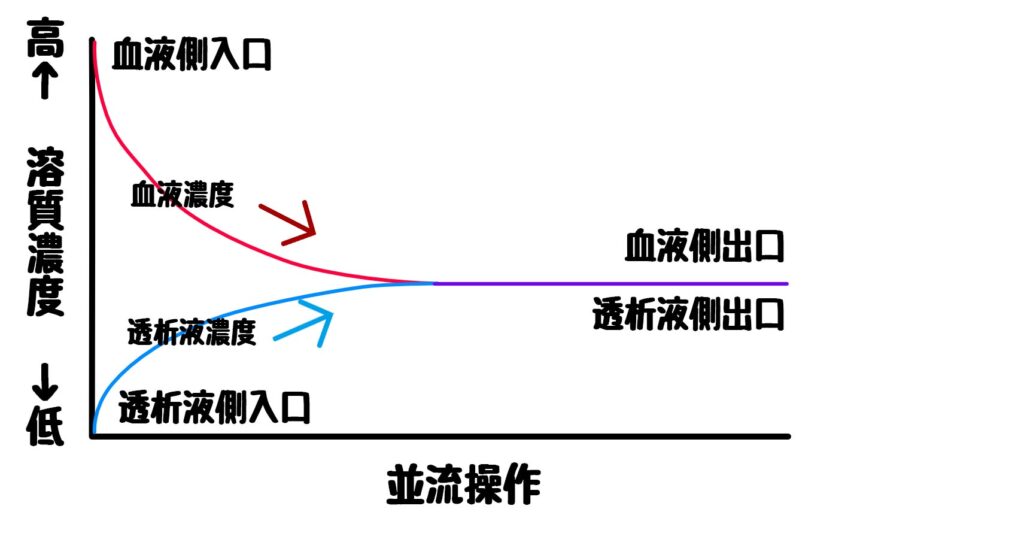
〇並流にした場合
入口では濃度差が大きく、溶質の移動量は大きいが、出口に向かってだんだん濃度差が小さくなるため、溶質の移動量は小さくなる。
溶質の濃度が血液中と透析液中で等しくなると溶質の移動が終わってしまう。
実際には等しくなることはないが溶質除去効率は向流に比べて落ちる。
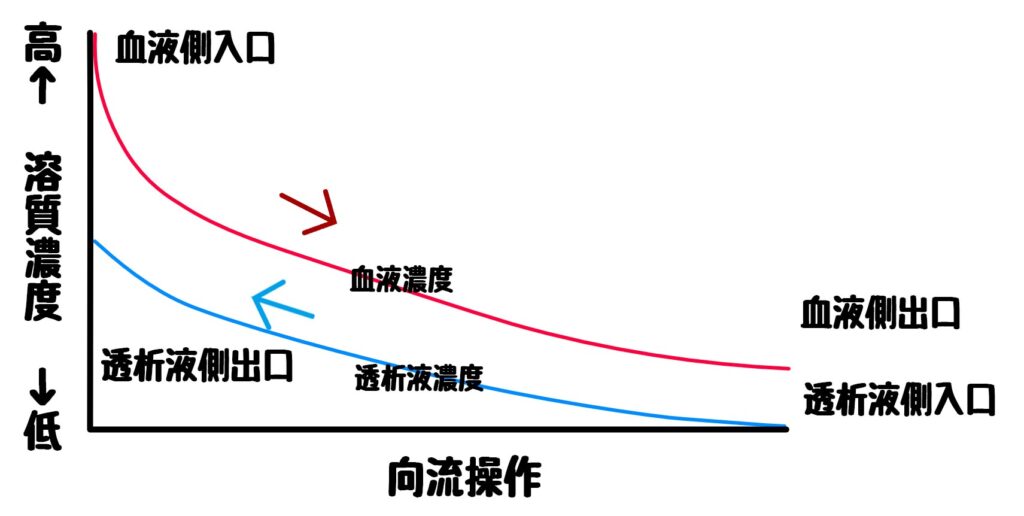
〇向流にした場合
血液側入口には透析液側にとって出口側となるり透析液中に溶質が移動しているため、この時点は並流ほどの濃度差はないが血液側出口に向かうにつれ、透析液は新鮮なものに近づき血液側出口付近では透析液側入口となりまだ溶質除去を行っていない(溶質濃度0)透析液であるため、十分な溶質除去が可能である。
向流は、血液側入口から出口まで濃度差を維持した状態を保つので効率的である。
実際の治療では拡散による溶質除去の他に、除水を行っているため多少の濾過による除去も行われている。
血液と透析液を向流に流すため、血液入口付近では、血液側の圧力が透析液側に比べ高く、逆に血液出口付近では、透析液側の圧力が血液側に比べて高くなっている。
血液入口付近圧力:血液側>透析液側
血液出口付近圧力:血液側<透析液側
上記の現象により、血液入口付近では血液側から透析液側に、血液出口付近では透析液側に濾過が生じる(これを内部濾過という)
正濾過領域では血流の流れる方向に向かって血液流量は減少し、逆濾過領域では血液流量は増加する。
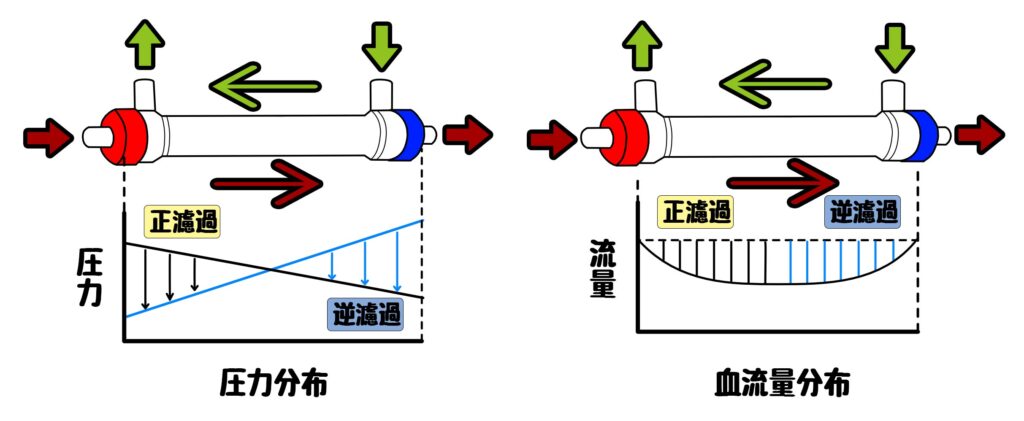
膜の透水性が高い、血液側および透析液側の圧力損失が大きいモジュール構造であるほど、内部濾過量が多くなる。
現在使用されている高透水性の透析膜を用いたダイアライザには分子量の大きい物質の除去を向上させるため、内部濾過を促進したものがあり、HDの治療であっても実際には濾過による物質移動の特徴を持つダイアライザもある。
また、透析液流量は大よそ500mL/minで行っている施設が多いと思う、効率上げるには透析液流量増やせばいいのではないかと考えると思いますが、血液透析のクリアランスは血液流量を超えることはないので、いくら透析液流量を上げたとしてもそこまで効率が上がるというわけではありません。
おおよそ血液流量の2倍程度の透析液流量で十分で、それ以上透析液流量を増やしても同一血液流量の場合、クリアランスはほぼ頭打ちになるようです。
血液透析の臨床的適応
- 腎不全
まとめ
- 溶質除去の基本原理は拡散
- 小分子領域の除去に優れてる
- 除水による濾過、内部濾過により多少の中・大分子領域の除去も行えるがHFやHDFには劣る
- HDのクリアランスは血液流量(QB)を超えない
血液濾過(HF:hemofiltration)
血液濾過の特徴
HFは透析液を流さずに膜を介して圧力差により血液の一部(水)を移動させる。
この時、同時に血液中に溶け込んでいる物質も一緒に移動するが膜の細孔より大きい物質は膜を透過できない。
膜の細孔より大きいものは膜を透過できない、細孔よりも小さいものは膜を透過できる(ふるいの原理)
この透過の割合を示したものをふるい係数(SC)という。
HFのクリアランスは濾過流量より大きくなることはないこと。
HFは生体人の糸球体機能を模した概念であり、大分子量溶質までの溶質除去に効果がある。
しかし、生体人における尿細管機能がないため、電解質、酸塩基平衡の調製は補充液の投与によって行われる。
濾液量=補充液量は厳密なバランスが要求される。
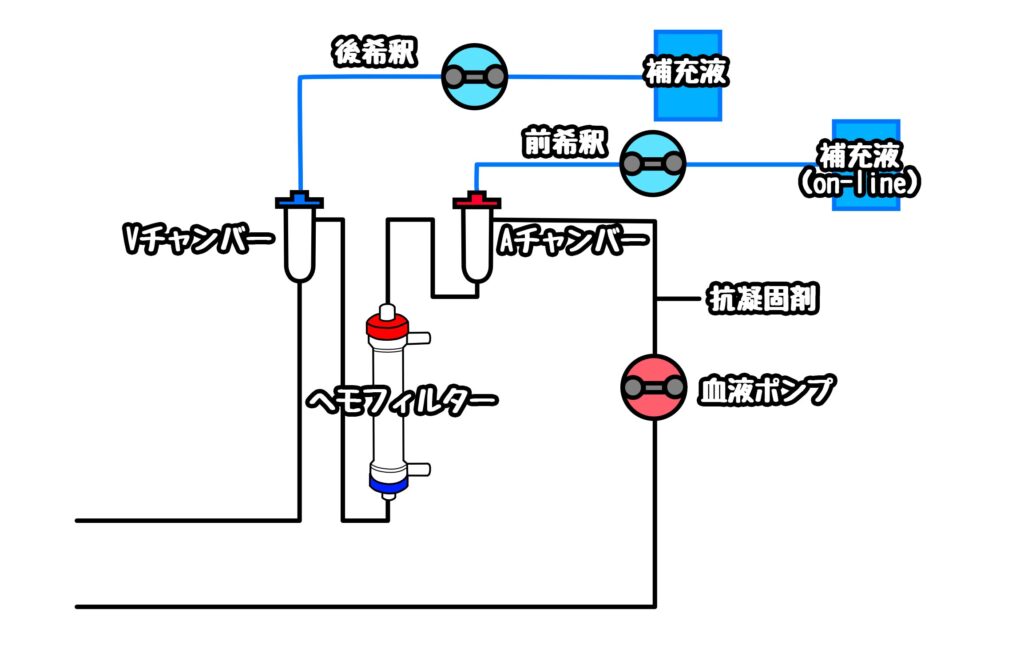
前希釈HF
ヘモフィルターの手前で置換液を補充する、血液が希釈され、ヘモフィルター表面の蛋白質の濃度分極層の形成が少なく目詰まりを防ぐことが可能である。
しかし、血液が希釈されるため除去効率が低下する。
除去効率を上げるためには大量置換が必要となる(70L程度)
オンラインHFの場合は、前希釈HFが可能となるが、オンラインができない環境にある施設の場合は大量置換ができない為、後希釈HFと同様の血液流量の1/3程度の濾過流量で行うしかない。
後希釈HF
ヘモフィルターで濾過されたのちに置換液が補充される。
クリアランス向上のために濾過流量を上げると溶質除去量は多くなるが、血液流量に対する濾過流量の比が大きくなると、血液側出口において血液濃縮が生じ、溶血が起こりやすくなる。
また、濃度分極層、ゲル層の形成、膜の目詰まりなども大きくなり、濾過性能は経時的に減少するため、むやみに濾過流量を増やすことはできない。
通常、濾過流量は血液流量の1/3程度が上限と言われている。
前置換とは違い、血液の希釈がされないので、少ない濾過流量で除去効率を稼ぐことができる。
血液濾過の臨床的適応
現在、血液濾過が選択されるということはほどんどない。
血液濾過は濾過に伴い、細胞外液と浸透圧が近い等張液を置換することで浸透圧や酸塩基平衡の変化が緩徐となる特徴があるため、細胞内外液の格差が少なく不均衡症候群を起こしにくい。
循環動態が不安定(心不全・心筋梗塞など)、脳血管障害(脳浮腫)などがよい適応になる。
濾過により、中~大分子量物質まで除去できるため、長期透析患者に合併する透析アミロイド症やイライラ感、掻痒感などの不定愁訴が適応となる。
しかし、小分子量物質の除去が不十分なため透析患者で上記のような症候がある患者には血液濾過ではなく後述する血液濾過透析がよい適応となる。
まとめ
- 溶質除去の基本原理は圧力差(膜間圧格差:TMP)
- 透析液は流れておらず、拡散による小分子量領域の除去はHDに比べ悪い
- 中~大分子量領域の除去はHDに比べ優れる
- 濾過によって抽出した濾液と同量の置換液を補充する
- 置換液の補充箇所により前希釈、後希釈に分類される
- 前希釈は濾過前に血液を希釈するので除去効率が後希釈に比べ低いが目詰まりのリスクは低い
除去効率を上げるためには置換液量を増やす必要があるがoff-line HFの場合困難である - 後希釈は濾過後に血液を希釈するので除去効率は良いが、ヘモフィルタ内で血液濃縮が起こるため、目詰まりのリスクが高い
血液流量の1/3程度の濾過流量までしか増やせない - HFのクリアランスは濾過流量(QF)とふるい係数(SC)によって決まる
- HFのクリアランスは濾過流量(QF)を超えない
- 浸透圧変化が少ないので血圧低下が抑えられたり、循環動態不安定、脳血管障害のある患者に良い適応となる
- 現在ではHFを第一選択とすることはほぼない
血液濾過透析(HDF:hemodiafiltration)
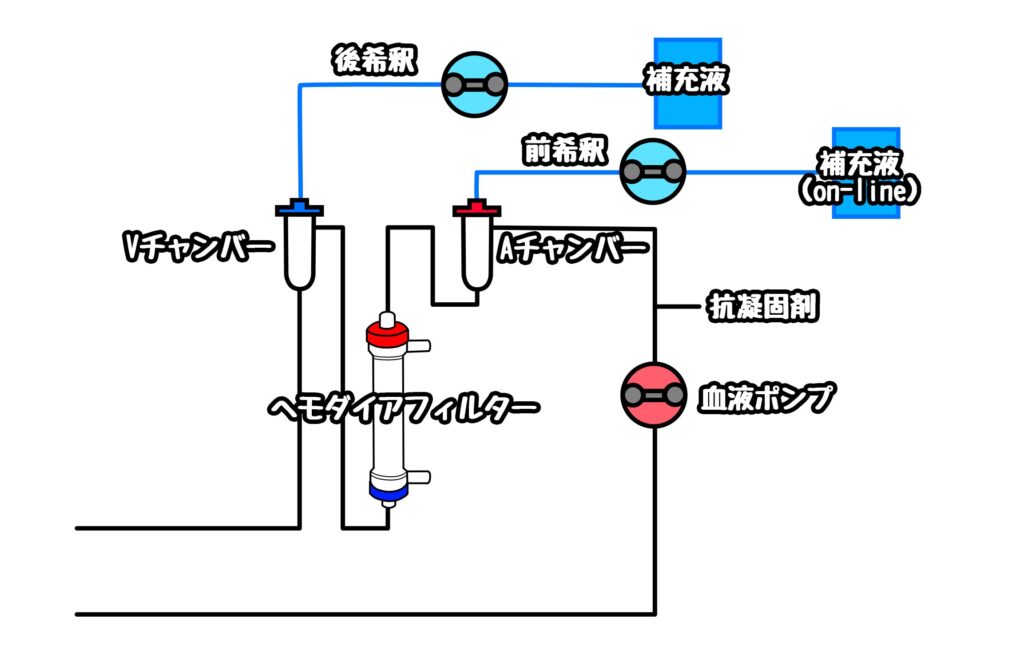
血液濾過透析の特徴
簡単に言うと血液透析と血液濾過を合わせたもので、お互いのデメリットをお互いのメリットでカバーしている治療法です。HDFは透析液を流して、拡散による小分子量領域の溶質除去を行い、濾過によって中~大分子量領域の溶質除去を行い、置換液を補充します。
置換液の補充する位置によって前希釈HDF、後希釈HDFと呼びます。
前希釈、後希釈についてはHFの項目を参照ください。
HDFのおいての拡散効率は通常のHDと比べて低下する。
前希釈の場合:血液希釈により低下
後希釈の場合:血液濃縮により低下
クリアランスについては、前希釈と後希釈で異なる。
後希釈HDFでは濾過流量(QF)の増加とともに小~大分子量領域の溶質のクリアランスは増加する。
前希釈HDFでは濾過流量(QF)の増加によってそうクリアランスは増加するが置換液の補充により、ヘモダイアフィルタへ流入する血液濃度が減少するため拡散によるクリアランスが低下するのでそうクリアランスは低下する。
On-lineHDFの場合、透析液の一部を補充液として使用するため、QF増加に伴うヘモダイアフィルタへ流れる透析液流量の減少を回避するためにトータルの透析液流量(補充液+透析液)を増やすかQBを増やすなどの対策が必要です。
トータルの透析液流量(コンソールに流入する透析液流量というイメージ)
トータルの透析液流量を500mL/min、濾過流量を100mL/minとした場合、補充液流量は100mL/minとなります。
トータルの透析液流量から補充液流量の100mL/minを引いた400mL/min がヘモダイアフィルタへ流れることになります。
逆にヘモダイアフィルタに流れる量を500mL/minとしたい場合、トータルの透析液流量を500mL/min+100mL/min(補充液分)の600mL/minとするとQDは500mL/minとなります。
濾過流量(QF)の増加に伴う弊害にはアルブミンの喪失が増加する。
血液濾過透析の臨床的適応
HDFはHDを併用しているため、HFで述べた緩徐な浸透圧変化にすることができないので脳圧亢進状態や緑内障での使用は不適切である。
HDFの目的はHDでは除去できなかった中~大分子量領域の除去効率を上げることである。
- EPO抵抗性貧血症例
- β2MG増加症例
- 関節痛、掻痒感、イライラ感、不眠などの不定愁訴症例
- 透析低血圧症例
- 低栄養状態
- 動脈硬化
- 残存腎機能の保持
まとめ
- 溶質除去の基本原理は圧力差(膜間圧格差:TMP)と拡散
- 透析液は流れているが拡散による除去効率は血液希釈や血液濃縮のためHDより劣る
- HD、HFのデメリットをお互いのメリットで補っているため、小~大分子量領域の溶質除去が可能
- 濾過によって抽出した濾液と同量の置換液を補充する
- 置換液の補充箇所により前希釈、後希釈に分類される
- 前希釈は濾過前に血液を希釈するので除去効率が後希釈に比べ低いが目詰まりのリスクは低い
除去効率を上げるためには置換液量を増やす必要があるためOn-line HDFで行う必要がある
その際はトータルの透析液流量を増やしたり、QBを増やして拡散効率を上げる必要がある - 後希釈は濾過後に血液を希釈するので除去効率は良いが、ヘモダイアフィルタ内で血液濃縮が起こるため、目詰まりのリスクが高い
血液流量の1/3程度の濾過流量までしか増やせない
前希釈HDFのクリアランスは、濾過流量(QF)の増加により総クリアランスは増加するが、拡散によるクリアランスが低下するため総クリアラスは低下する - 後希釈HDFのクリアランスは、濾過流量(QF)の増加により増加する
- HFのクリアランスは濾過流量(QF)を超えない
- HDを行うため、浸透圧変化を緩徐にすることができないが血液と等張な置換液を補充することでHDよりは浸透圧変化が少ないため透析低血圧を防ぐことができる
- 濾過流量(QF)の増加によりアルブミンの喪失が起こってしまうので、あまり濾過をかけすぎない設定にするか前希釈HDFで行う

